LA CHIMIE

La molécule de l'eau.
L'atome d'oxygène ne comporte que six électrons sur un total possible de huit sur la couche de valence.
La place des deux électrons absents peut être occupée par deux électrons appartenant à deux autres atomes.
Ainsi, deux atomes d'hydrogène liés par leur unique électron à l'atome d'oxygène produisent une molécule d'eau.
Mais les deux électrons d'un même atome, le carbone par exemple, produisent plutôt une liaison covalente.
![]()
![]() Page d'accueil :
La
matière est faite d'ondes.
Page d'accueil :
La
matière est faite d'ondes.
|
Des hypothèses seulement. Si je fais erreur, je m'en excuse. Devant l'inconnu, il faut imaginer des hypothèses qui concordent avec un certain nombre d'indices. Hélas, il arrive qu'on se méprenne, et c'est donc le lot des chercheurs de se tromper le plus souvent. Par contre, si cette approche de la chimie devait être la bonne, on devra reconnaître que tout le reste, sur lequel elle s'appuie, est vraisemblablement correct. Je ne suis pas chimiste. Ne vous attendez pas à trouver dans cette page le secret de liaisons miraculeuses. Parce qu'ils ont travaillé très fort pour ça, les chimistes savent bien mieux que moi de quelle manière les atomes se groupent en molécules. Le problème, c'est qu'ils ignorent pourquoi, d'où le propos de cette page. On s'en tiendra donc ici à la chimie élémentaire. C'est bien suffisant pour découvrir quelles sont - ou pourraient être - les forces impliquées. Les cônes d'ombre. On aura vu à la page précédente que le noyau de l'atome produit un rayonnement radial tous azimuts à travers lequel se situent huit cônes d'ombre orientés selon les huit sommets d'un cube. Tout indique que ces cônes jouent un rôle capital en chimie, puisque ce sont eux qui capturent jusqu'à huit électrons sur la couche externe des atomes. Il est donc nécessaire d'évaluer d'abord comment ils agissent. |
LE MÉCANISME DES CÔNES D'OMBRE
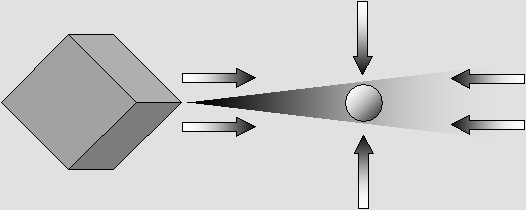
L'électron subit plusieurs forces distinctes qui l'obligent à demeurer à l'intérieur du cône d'ombre.
|
L'effet d'ombre et la pression de radiation. On montre à la page sur la mécanique ondulatoire que l'électron est amplifié par les ondes de l'éther et qu'il émet un rayonnement constant. Le noyau de l'atome, qui est fait exclusivement d'électrons étroitement assemblés, rayonne autant d'énergie qu'il en prélève à même les ondes de l'éther. En moyenne, la pression de radiation est alors égale à l'effet d'ombre, ce qui fait qu'une particule neutre présente dans les environs ne devrait pas en être affectée. Mais parce que
cette énergie n'est pas répartie de manière uniforme autour du noyau,
il se forme des axes où règnent des effets d'attraction ou de
répulsion. Les électrons qui constituent ce noyau se comportent en
tous points comme des antennes émettrices, ou plus exactement comme des
haut-parleurs omnidirectionnels. Les physiciens qui connaissent bien
leur diagramme de rayonnement savent qu'il est tout à fait impossible
que deux ou plus de ces émetteurs émettent des ondes tous azimuts
d'une manière absolument uniforme.
Les directions privilégiées.
Il se forme obligatoirement des lobes, qui représentent ce qu'ils appellent des « directions privilégiées ». Cela signifie que l'espace entre ces lobes représente plutôt une zone de moindre énergie, où le rayonnement est plus faible. Pour la même raison, le proton et le noyau de l'atome étant manifestement composés d'un ensemble de particules, ils ne peuvent pas émettre leurs ondes d'une manière uniforme. Il est bien établi aujourd'hui que la matière possède des propriétés ondulatoires, et il serait plus que temps qu'on réalise que ces ondes que la matière cache existent vraiment. Ce ne sont pas seulement des équations. Si,
sur un axe donné, l'énergie rayonnée est supérieure à la moyenne,
la pression de radiation sera supérieure à l'effet d'ombre et il en
résultera un effet de répulsion. Si au contraire cette énergie est
inférieure, c'est plutôt l'effet d'ombre qui dominera, d'où un effet
d'attraction. C'est pourquoi le noyau de l'atome attire un
électron s'il est placé à l'intérieur d'un cône d'ombre, même sans
tenir compte de la force de Coulomb exercée par le proton. Ce
phénomène explique qu'il existe des ions et des liaisons ioniques.
La loi de Coulomb. Il arrive donc qu'un cône d'ombre justifie la présence d'un électron en surnombre. C'est généralement le cas des atomes possédant plus de quatre électrons périphériques. Alors l'ensemble possédera une charge négative additionnelle. Mais si le nombre de ses électrons périphériques est inférieur à quatre, ce qui est le cas général des métaux, il peut arriver tout aussi bien qu'un atome perde un de ces électron de manière à devenir plutôt positif. De cette manière, l'effet d'attraction mutuel entre ces deux atomes ionisés produit une liaison chimique du type ionique. De plus, les métaux ne possédant généralement qu'un ou deux électrons périphériques, qui sont très peu liés à leur noyau, ils conduisent facilement l'électricité. Puisque les cônes d'ombre produisent un effet d'attraction sur n'importe quelle particule, ajoutons enfin qu'ils peuvent agir aussi sur le noyau d'un autre atome. Ce dernier se trouve alors forcément à une plus grande distance, d'ou une force nettement inférieure. C'est en partie ce qui explique les forces de Van der Waals, comme on le verra plus loin. L'électron ne tourne pas autour du noyau. Mais d'un autre côté, pour des distances inférieures à 10 -12 m, soit environ cent fois moins que le rayon normal de la couche périphérique d'un atome, la loi de Coulomb n'est plus valide. On explique que c'est parce que la charge ne peut plus être considérée comme « ponctuelle », et c'est tout à fait juste. Cela invalide le raisonnement de Hantaro Nagoaka, d'Ernest Rutherford et de Niels Bohr, qui prétendaient que les électrons devaient obligatoirement tourner comme des planètes autour du noyau pour éviter de chuter sur lui. Personne n'a jamais démontré que les électrons tournaient vraiment de cette manière. La « mode » actuelle consiste à montrer les orbitales sous des formes tridimensionnelles hallucinantes, voire délirantes. Selon la théorie quantique, on préfère parler d'un nuage d'électron, ce qui est assez juste puisque les ondes stationnaires des électrons d'un atome se superposent franchement. Par contre on ne saurait parler d'une probabilité que son centre géométrique se situe en un point quelconque : il se situe en fait en un point très précis. S'il existe un principe d'Incertitude, c'est tout simplement parce que n'importe quel méthode de repérage a pour effet de le déplacer, ce qui rend toute confirmation ultérieure impossible. De plus, parce qu'il changerait constamment de direction, il est bien établi qu'un électron en orbite devrait produire un « rayonnement synchrotron » jusqu'à immobilisation totale. L'hypothèse de Bohr est non seulement complexe et suspecte, mais depuis un siècle elle n'a été appuyée par aucune observation concluante. Et pourtant ce mouvement de rotation a continué de sembler une évidence pour la plupart des chimistes. À mon sens ils auraient dû se montrer plus prudents et conserver l'hypothèse des cubes de Lewis, en guise d'alternative, ne serait-ce que parce qu'elle fonctionne. Il m'a donc fallu beaucoup de courage - ou d'inconscience - pour prétendre que les électrons occupent à la fois un grand volume et un centre fixe bien déterminé. Une telle hypothèse va à l'encontre de toutes les théories actuelles. Il faut pourtant convenir que cela permet d'expliquer beaucoup mieux leurs propriétés, et ici tout particulièrement, la forme géométrique des molécules et des cristaux. Même s'il est positif, le noyau repousse l'électron s'il vient trop près. En réalité, l'électron est fait d'ondes stationnaires sphériques. Même s'il est perçu comme un point, il occupe un certain volume. Supposons que l'électron s'approche du noyau de trop près. Alors son centre se trouve à l'intérieur de la partie très étroite d'un cône d'ombre. Ses ondes périphériques se trouveront en fait majoritairement dans toute la zone extérieure, là où le rayonnement du noyau est supérieur à l'effet d'ombre, et il sera finalement repoussé. De plus, il est faux de prétendre que l'atome est fait principalement de vide. Son noyau en particulier est une véritable « boule d'énergie » faite d'ondes stationnaires sphériques qui s'étendent bien au-delà de la couche de valence. Toutefois cette énergie croît selon l'inverse du carré de la distance et elle est donc énorme à proximité du noyau. On sait aussi que l'énergie de chaque proton et neutron vaut près de 2000 fois celle d'un électron, ce qui fait que l'énergie du noyau de l'atome d'oxygène vaut près de 30000 fois celle d'un seul électron. De cette manière, puisque les ondes stationnaires de l'électron s'étendent aussi dans un espace considérable, celles qui sont situées à proximité du noyau baignent dans une énergie beaucoup plus intense que du côté opposé. Pour un rayon donné, la différence s'accentue à mesure qu'il s'approche du noyau. Ces sont ses ondes stationnaires les plus près du noyau qui en seront amplifiées davantage. C'est pourquoi la pression de radiation le repoussera plus loin, malgré la présence d'une charge fortement positive dans le noyau. Un point d'équilibre. Ainsi donc, s'il est situé à l'intérieur d'un cône d'ombre, et si l'atome comporte un nombre égal de protons et d'électrons, chaque électron sera attiré en moyenne par la charge de l'un de ces protons. Il sera même attiré un peu plus près du noyau que ne le justifie la loi de Coulomb parce qu'il est situé à l'intérieur d'un cône d'ombre. Mais il sera repoussé par ce noyau s'il s'en approche de trop près. Il existe donc un point d'équilibre à mi-chemin. S'il y a plusieurs électrons à l'intérieur du même cône d'ombre, il existera autant de points d'équilibre, compte tenu de l'effet de répulsion qui existe entre chacun d'eux. Un amas d'électrons très élastique. De plus, même en présence d'un noyau fortement positif, les très nombreux électrons d'un atome lourd devraient respecter une distance minimum entre eux puisqu'ils se repoussent. L'amas d'électrons occupe alors forcément un volume plus grand, même si les couches internes se situent plus près du noyau. D'une façon générale, on peut donc s'attendre à ce que les atomes lourds soient plus grands. Malgré le fait que leurs cônes d'ombre soient plus puissants, les électrons périphériques en occupent la section la plus éloignée et la plus faible. Ainsi, une liaison chimique d'un type donné impliquant un atome lourd est également plus faible. S'il n'y a qu'un seul électron sur la couche périphérique, c'est qu'il y a sept protons en moins dans le noyau comparativement au gaz noble situé sur la même rangée du tableau de Mendeleïev, et dont la couche externe est saturée . Cet électron devrait ainsi être repoussé encore plus loin par tous les autres, ceux-ci étant eux-mêmes plus espacés. Cela explique que, même s'il est plus lourd, l'atome d'un gaz noble soit plus petit que celui du métal alcalin (du lithium au césium) comportant le même nombre de couches électroniques. Les forces latérales. Si l'électron préfère se situer à l'intérieur d'un cône d'ombre, c'est donc plus exactement parce qu'il tend à s'éloigner des 15 axes où le rayonnement des champs gluoniques est le plus intense. Au moins cinq forces. 1.- La force de Coulomb attire l'électron vers le proton du noyau. 2.- L'effet d'ombre à l'intérieur du cône d'ombre l'attire également vers le noyau. 3.- Le rayonnement des 15 champs gluoniques le repousse à l'intérieur des cônes d'ombre. 4.- L'énergie considérable présente au voisinage du noyau l'éloigne de celui-ci. 5.- La force de Coulomb exercée par les électrons voisins l'oblige à garder ses distances. En règle générale, sauf pour la force de Coulomb, on peut donc dire qu'un électron se dirige généralement là où le rayonnement est le plus faible, c'est à dire à l'intérieur des cônes d'ombre. Pour la même raison, si l'espace vient à manquer, il se positionnera à l'intérieur de l'une des hyperboles montrées à la page précédente. Des forces réciproques. Il importe de préciser qu'en vertu de la loi de l'action et de la réaction, toutes ces forces sont réciproques. Un électron captif à l'intérieur d'un cône d'ombre peut donc tout aussi bien attirer à lui un cône d'ombre appartenant à un autre atome, s'il se situe suffisamment près. Des oscillations suivies d'une stabilisation. On a vu à la page sur la lumière que l'électron qui vient d'être capturé par un atome ou qui a changé de position se met à osciller. Il le fait sur une fréquence qui dépend de sa propre inertie, qui est constante (d'où la constante de Planck). Cette fréquence dépend aussi de la force qui le lie à son atome, compte tenu de la présence d'autres électrons tout autour de lui. On peut donc s'attendre à ce que l'énergie des ondes qu'il émet soit proportionnelle à la fréquence. C'est ainsi qu'il émet de la lumière dans le spectre visible et invisible. C'est pourquoi chaque atome possède ses raies spectrales caractéristiques, toujours les mêmes. Mais en vertu de la loi de l'action et de la réaction, un électron qui se déplace ainsi agira par ses ondes sur les électrons voisins et sur tous les atomes voisins, qui réagiront à leur tour en lui retournant un rayonnement qui aura pour effet de le ralentir, puis de l'immobiliser. Généralement, en plus de la lumière émise, une partie de cette énergie sera donc convertie en vibrations des atomes et des molécules, et donc en chaleur. Très clairement, l'énergie cinétique de cet électron au moment de sa capture correspond à un quantum de lumière. L'énergie nécessaire pour l'expulser de sa position est forcément identique, et il en résultera une charge, d'où une réaction chimique ou un effet photoélectrique. On peut donc à juste titre parler d'un photon de lumière, mais c'est à la condition de faire allusion à une quantité d'énergie et non à une particule.
LE SPIN ET LES CHAMPS MAGNÉTIQUES Le rayonnement des quarks, qui contiennent deux électrons, présente de grandes similitudes avec celui de deux antennes d'émission alimentées en phase, en opposition de phase ou en quadrature. Le diagramme de rayonnement de telles antennes dites « en réseaux » est bien connu. Mais il importe de souligner ici que dans ce cas, leur rayonnement ne fait pas que s'additionner selon des interférences additives et constructives. On parle véritablement de réactance, ce qui signifie que chaque antenne réagit favorablement ou défavorablement au rayonnement de l'autre. Il en résulte une modification appréciable du rayonnement de l'ensemble, qui se fait alors souvent fortement dans une direction privilégiée, au détriment des autres directions. C'est d'ailleurs pour cette raison que le proton produit des cônes d'ombre. C'est particulièrement évident dans le cas d'une antenne « yagi », dont les éléments dits « parasites » ne sont même pas alimentés en courant, et qui sont néanmoins capables de modifier considérablement le rayonnement du dipôle principal. On montre ci-dessous que le positron central et chacun des deux électrons présents à l'intérieur d'un des trois quarks du proton peuvent produire un rayonnement polarisé : |
|
|
Le rayonnement d'un électron et d'un positron, ou de deux antennes alimentées en quadrature.
Le rayonnement, plus intense que selon l'addition simple de l'amplitude, se fait dans une direction privilégiée.
Toutefois l'électron et le positron, ce dernier étant situé au centre du proton, sont faits d'ondes stationnaires.
Alors un rayonnement convergent remplace l'absence de rayonnement, à la droite de l'axe :
|
|
Noter le rayonnement non stationnaire et unidirectionnel, sur l'axe.
Ce rayonnement est polarisé, d'où des pôles nord et sud, et donc un champ magnétique.
Il est clair qu'un électron « célibataire », c'est à dire non jumelé, engendre un tel champ en tandem avec le proton.
Mais le champ magnétique est annulé si un électron du spin opposé est présent de l'autre côté du proton.
|
Le principe d'exclusion de Pauli ne suffisait pas. On a ici une explication claire et vraisemblable : on comprend enfin pourquoi les électrons d'un atome se regroupent systématiquement par deux, un de chaque spin, et pourquoi un électron célibataire produit un champ magnétique. Cette explication demeure valable dans le cas de tous les atomes d'une même molécule, ce qui conduit à une règle de l'alternance du spin à travers toute la matière le long d'un axe donné. On a même constaté que c'est aussi le cas pour les électrons qui circulent dans un conducteur à très basse température, d'où la supraconductivité.
LA LIAISON IONIQUE Les éléments alcalins comme le sodium ne comportent qu'un ou deux électrons périphériques, et alors ceux-ci sont relativement isolés. Ils ne sont pas liés très fortement à leur cône d'ombre. C'est donc le cas de la plupart des métaux, qui laissent leurs électrons périphériques vagabonder d'un atome à l'autre, de manière à produire un courant électrique dès qu'une tension est appliquée. D'un autre côté on a vu que les atomes dont la couche périphérique est presque complète, comme celui du chlore, tendent au contraire à compléter cette couche. C'est dû au fait qu'un cône d'ombre attire un électron même en l'absence d'une charge positive dans le noyau, et que les électrons contigus situés sur la même couche exercent une force essentiellement latérale, et non pas franchement dirigée vers l'extérieur. C'est ainsi que lorsque le chlore réagit avec le sodium, il lui emprunte son électron isolé. Toutefois, cet électron était le seul à partager le même cône d'ombre avec un autre. Ce dernier profite donc de l'espace libre pour rétablir la symétrie de l'atome, qui ressemble alors à celui du gaz noble voisin, soit le néon. De son côté, l'atome de chlore a complété sa couche externe et il ressemble à celui d'un autre gaz rare, l'argon. Il s'agit d'une découverte de Walther Kossel, faite en 1916. Or l'argon et le néon réagissent très peu ensemble. Non seulement leur couche périphérique est saturée, mais ils sont électriquement neutres. Au contraire, les deux atomes modifiés sont des ions, l'un positif et l'autre négatif. C'est pour cette raison qu'ils se joignent en une molécule, comme ceci : |
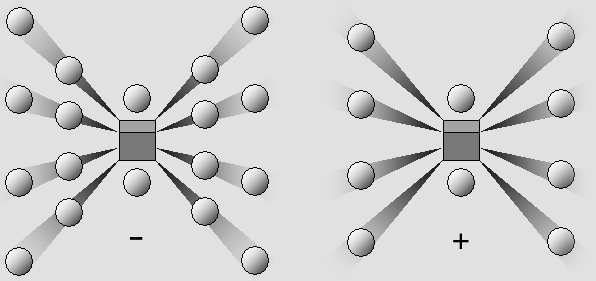
La liaison ionique : le chlore (à gauche) emprunte un électron au sodium, qui devient positif.
Seule la force de Coulomb agit. Les cônes d'ombre ne sont pas impliqués en première analyse.
Mais on verra plus loin que les forces de Van der Waals utilisent ces cônes pour renforcer la liaison.
|
Les deux atomes qui constituent la molécule de chlorure de sodium, soit le sel de table, ont réellement une structure cubique complète. Même si leur taille n'est sans doute pas tout à fait la même, la forme cubique du cristal qu'ils formeront devient évidente. La liaison est très particulière parce que les deux atomes ne sont pas vraiment liés. Les effets d'attraction se font tout simplement en raison inverse du carré de la distance, mais ils sont contrecarrés dès que les électrons se rapprochent trop. Si un autre ion s'approche de cette molécule, il peut facilement prendre la place de l'autre peu importe à quel élément il appartient. En solution dans l'eau, la liaison ionique peut se rompre facilement. Les atomes sont très agités à cause de la chaleur et les molécules de l'eau possèdent également des pôles positifs et négatifs qui perturbent les liaisons, ce qui explique que le sel soit soluble dans l'eau. Et si l'on plonge une électrode dans une telle solution, on peut aussi comprendre pourquoi elle sera en mesure de capturer les ions de charge contraire.
LA LIAISON SIMPLE Fondamentalement, sauf dans le cas particulier d'une liaison ionique, une liaison chimique est donc le résultat d'un phénomène d'attraction entre un électron et deux cônes d'ombre, comme le montre le diagramme suivant : |

La liaison simple.
Un seul électron peut lier fortement deux atomes par l'intermédiaire de deux cônes d'ombre.
Deux autres cônes d'ombre se croiseront éventuellement de manière à renforcer la liaison.
LA LIAISON COVALENTE
Dans la liaison « covalente », les deux atomes mettent en commun leur électron « célibataire ».
Il existe deux angles de liaison selon que le deuxième électron est sur le côté ou sur la diagonale.
Cette structure à deux pivots montre qu'il peut se produire un effet de charnière.
Pour cette raison, la liaison par la diagonale aboutit plus facilement à une deuxième liaison covalente.
|
Une liaison ne s'établit pas facilement car les atomes libres sont relativement espacés. Ils sont d'ailleurs le plus souvent déjà associés en molécules et il est improbable que des cônes d'ombre libres se recoupent. Leur effet décroît rapidement avec la distance et il est semble-t-il presque nul à une distance qui correspond au rayon de Van der Waals, disons environ deux fois le rayon normal de l'atome. Si
les atomes impliqués sont relativement froids, ils ne vibrent pas
suffisamment pour que cette situation se produise.
Mais s'ils sont chauffés,
ou s'ils sont fortement comprimés, ils viendront très près l'un de l'autre tôt ou
tard. Il pourra à l'occasion se produire d'abord une dissociation d'une
molécule plus fragile. Puis deux
de leurs cônes d'ombre se croiseront et l'électron présent à
l'intérieur de l'un d'eux les enclenchera définitivement. Une
réaction en chaîne. Ce processus d'enclenchement produit beaucoup de chaleur additionnelle parce que la liaison agit comme un ressort très puissant. C'est un peu comme si une bille roulait au fond d'une cavité concave pratiquée dans un plan horizontal : alors elle devrait se mettre à osciller comme un pendule jusqu'à immobilisation. De la même manière, au moment de la jonction, les deux atomes se mettent à vibrer fortement et ils communiquent cette vibration à tous les atomes voisins. Puis ces atomes font à leur tour l'objet d'une liaison, et l'on assiste donc à une réaction en chaîne. C'est
ce qui se produit quand une bûche brûle dans la cheminée. Il faut la
chaleur de la flamme d'un
briquet ou d'une allumette pour démarrer le processus, mais ensuite ce
phénomène se
renouvelle jusqu'à épuisement de la matière première. Le
carbone et l'oxygène. Le feu ordinaire fait intervenir des atomes de carbone et d'oxygène, mais le carbone est généralement déjà lié à l'intérieur d'une molécule plus complexe. Ces deux éléments sont parmi les plus actifs. Cela tient au fait qu'ils possèdent un nombre restreint d'électrons, ce qui permet de n'en placer qu'un seul par cône d'ombre. Ils y sont donc fortement ancrés. De plus, ces atomes comportent deux ou quatre cônes d'ombre inoccupés, ce qui favorise les liaisons covalentes. Dans un premier temps, l'oxygène et le carbone peuvent donc s'associer sous forme de monoxyde de carbone, en double liaison covalente : |
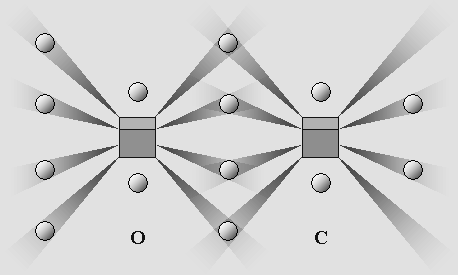
Le monoxyde de carbone.
L'atome d'oxygène est saturé, mais il reste deux cônes d'ombre inutilisés du côté du carbone.
L'ensemble peut donc accepter un autre atome d'oxygène de manière à former du CO2.
Mais il peut aussi annexer d'autres éléments, par exemple deux atomes d'hydrogène (formaldéhyde), etc.
|
La théorie du carbone asymétrique. Les chimistes Van't Hoff et Joseph Le Bel ont découvert dès 1874 que dans une molécule, les liaisons du carbone sont orientées du centre vers les sommets d'un tétraèdre. On parle aujourd'hui de stéréochimie et de « centre chiral », certaines molécules possédant un double non superposable, tel qu'il serait vu dans un miroir (d'où l'allusion à la main). Ceci
indique très clairement que dans le cas du carbone, ce sont les électrons
présents sur la diagonale d'un même côté du cube qui participent aux
liaisons, et que du côté opposé c'est plutôt la diagonale perpendiculaire.
Ces deux diagonales représentent en effet deux des arêtes d'un tétraèdre, et
selon que la liaison simple suivante se fait dans un sens ou dans l'autre, on
obtient des molécules asymétriques. Le
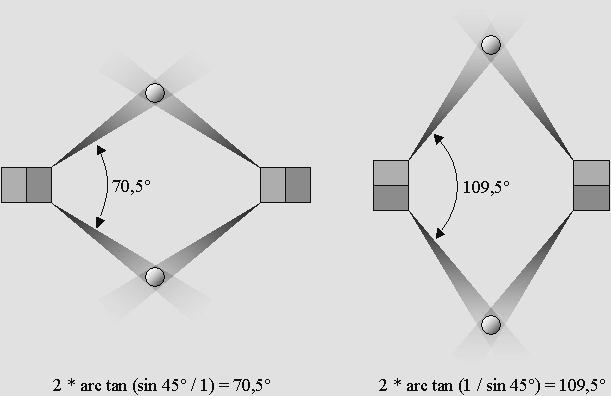
spin des électrons est déterminant. De plus, puisque selon toute vraisemblance le spin des électrons alterne d'un sommet du cube à l'autre, ceci donne à penser que les deux électrons d'un atome impliqués dans les liaisons chimiques covalentes à 109,5° devraient posséder le même spin. Mais ce ne serait plus le cas si les cônes d'ombre utilisés étaient voisins, c'est à dire à 70,5°. On a donc ici un exemple concret de cette nouveauté, qui est aujourd'hui mieux comprise, à l'effet que le spin des électrons est déterminant en chimie. Il en ressort qu'on pourrait faciliter ou orienter certaines réactions en sélectionnant d'abord les électrons selon leur spin. L'expérience de Stern et Gerlach est très révélatrice à ce propos, mais elle ne permet pas d'identifier le spin à coup sûr. Par exemple, il peut exister quatre sortes d'atomes d'hydrogène, et le même électron ne réagira pas de la même manière selon le spin du positron protonique auquel il est accouplé. |
LA GÉOMÉTRIE DU CUBE
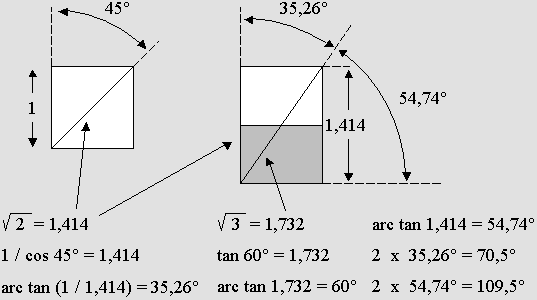
|
Les
électrons de la couche périphérique de l'atome présentent une
structure résolument cubique. Il s'agit plus exactement d'une structure
« cuboïde », car non seulement les dimensions d'un cube entier
peuvent varier considérablement, mais certains
axes peuvent facilement subir une distorsion sous l'effet de forces
asymétriques. Le
cube est compatible avec une grande variété de structures. C'est à cause de sa grande variété d'angles que le cube, s'il est désarticulé, devient compatible avec un grand nombre de structures. Les atomes qui se regroupent en molécules peuvent ainsi reproduire toutes sortes de formes. C'est particulièrement vrai dans le cas des cristaux. On retrouve ainsi bien évidemment le cube lui-même, mais aussi l'octaèdre régulier (les six électrons des quarks du proton sont disposés à la fois sur les six sommets d'un octaèdre et au centre des six faces d'un cube). On rencontre aussi très fréquemment le tétraèdre régulier. Ce dernier peut être obtenu en joignant les diagonales perpendiculaires de deux côtés opposés d'un cube. Il présente des triangles équilatéraux sur ses quatre faces et il préfigure la forme hexagonale si étonnante des cristaux de neige. Les chimistes devaient d'ailleurs s'interroger depuis longtemps sur les causes de la liaison de la molécule d'eau selon un angle fixe de 104,5°. En effet il n'existe autrement aucune raison particulière qui obligerait des atomes dont les électrons gravitent ou forment un nuage sans angle déterminé à respecter un tel angle, toujours le même. Les atomes tels qu'ils sont compris à l'heure actuelle présentent une symétrie radiale tous azimuts. Ils n'ont pas de pôles, pas d'axe, donc pas de symétrie axiale. Par ailleurs, les
représentations en relief d'orbitales polarisées qu'on peut trouver
sur l'Internet sont paraît-il élaborées selon des équations «
sophistiquées ». Disons plutôt qu'elles sont suspectes. Il faudrait être bien naïf pour ajouter foi à
des équations sans en connaître les fondements mécaniques. La
règle de l'octet. Un atome d'hydrogène ne comporte qu'un seul électron. Celui de l'hélium en comporte deux, et tous les autres atomes comportent également deux atomes seulement sur la première couche. Il semble bien que ces deux électrons centraux ne soient pas capturés par un cône d'ombre. La force qui les unit à leur atome semble plutôt de nature magnétique, ce qui implique que l'axe sur lequel ils se situent passe par le centre de deux faces opposées du cube, et non par deux sommets opposés. La fameuse règle de l'octet ne s'applique donc pas dans le cas des liaisons impliquant les électrons de l'hélium et de l'hydrogène. Mais dans tous les autres cas, cette règle de l'octet est obligatoire. La couche périphérique d'un atome ne saurait comporter plus de huit électrons actifs, c'est à dire capables de participer aux liaisons, puisqu'il n'y a que huit cônes d'ombre. Apparemment, il y a bien quelques exceptions dans le cas de certains composés du bore, du soufre et de l'iode. L'hexafluorure de soufre par exemple comporte six atomes de fluor liés autour d'un seul atome de soufre, mais ce n'est pas en soi un accroc à la règle de l'octet. Le nombre d'électrons présents sur les deux couches périphériques y est apparemment anormal, mais on ne voit pas bien où est le problème. Au besoin, il suffira de reformuler la règle de l'octet de manière à la fonder sur la présence maximum de huit cônes d'ombre par atome. En réalité, il est tout à fait normal que six atomes comportant plus de 5 électrons périphériques arrivent néanmoins à s'enclencher à un seul atome comportant également plus de 5 électrons. C'est que la moitié des liaisons peut se faire par cession d'un électron et l'autre moitié, par emprunt d'un électron, avec un total possible de 8. C'est d'ailleurs ainsi que le carbone arrive à constituer un diamant. Comme on l'a vu, le carbone et l'oxygène constituent des matériaux privilégiés. En premier lieu, chaque cône d'ombre ne comporte dans leur cas qu'un seul électron, ce qui produit des liaisons très solides. Ensuite, il est évident que l'absence de deux ou de quatre électrons permet des liaisons covalentes qui accentuent encore cette solidité. Il faut ajouter enfin que si le noyau contient un plus grand nombre de protons, ceux-ci exerceront un plus grand pouvoir d'attraction sur les électrons, toutes proportions gardées. De plus, les cônes d'ombre sont alors d'autant plus grands et puissants. On sait que les atomes plus lourds sont généralement plus grands, et pourtant l'atome d'oxygène est beaucoup plus petit que celui du lithium (on parle ici du rayon de la couche de valence). Ses six électrons périphériques sont profondément et solidement ancrés dans leur cône d'ombre. Au contraire, s'il y a plus d'un électron par cône d'ombre, le dernier y est moins solidement ancré. C'est donc l'oxygène, avec ses huit protons, qui répond le mieux à ces trois critères. Mais le carbone permet deux liaisons covalentes simultanément. Sans mauvais jeu de mot, il est donc plus polyvalent, ce qui compense le fait qu'il soit un peu plus grand à cause de ses six protons seulement. |
LA LIAISON HYDROGÈNE
|
Les
liaisons covalentes sont plus solides, mais
cela
n'exclut pas la possibilité de combler occasionnellement les vides à l'aide de liaisons
simples. C'est ainsi que l'hydrogène peut se révéler très utile. La
chimie organique : des milliers de combinaisons. Chaque fois qu'un atome d'oxygène ou de carbone n'utilise qu'un seul cône d'ombre pour réaliser une liaison simple, il en subsiste au minimum un deuxième en réserve, ou trois autres dans le cas du carbone. On peut ainsi construire toutes sortes de molécules plus ou moins complexes, en utilisant occasionnellement la liaison covalente de manière à renforcer le tout. Les cônes d'ombre vides peuvent ensuite être remplis par l'unique électron d'un atome d'hydrogène. C'est
précisément la présence de l'hydrogène qui permettra de produire des
substances non pas gazeuses, mais liquides ou solides. S'il en est
ainsi, c'est souvent à cause de la « liaison hydrogène ». Parce que l'unique
électron de l'hydrogène se trouve nécessairement orienté vers l'intérieur de la
molécule, le proton peut faire face à la partie d'une autre molécule
où se trouvent plutôt des électrons. Alors ce proton et ces électrons
pourront à leur tour subir un effet d'attraction, à cause de la force
de Coulomb. L'eau. On a vu que c'est la force de Coulomb qui permet les liaisons ioniques, mais cette force peut aussi agir selon des axes privilégiés même en l'absence d'ions. C'est particulièrement vrai dans le cas de la liaison hydrogène, parce que l'atome de l'hydrogène ne comporte qu'un seul électron. Si ce dernier est capturé par un autre atome, le proton sera forcément orienté vers l'extérieur de la molécule, et il attirera à lui les électrons des atomes voisins. Cette force additionnelle n'est pas suffisante pour créer une molécule plus grande, mais elle peut modifier considérablement les propriétés de l'ensemble. Elle peut même justifier des structures cristallines, à la condition de faire intervenir également les forces de Van der Waals. La molécule de l'eau constitue le meilleur exemple de la liaison hydrogène parce qu'elle comporte deux atomes d'hydrogène, et donc deux protons positifs orientés vers l'extérieur : |
La molécule de l'eau.
Les électrons de l'hydrogène ne sont pas nécessairement situés dans un cône d'ombre.
|
C'est pour cette raison que l'eau possède une grande cohésion. Elle gèle sous forme de glace à basse température, et elle peut demeurer liquide à une température relativement élevée avant de passer à l'état de vapeur. De plus elle possède une bonne tension de surface, ce qui lui permet de former des gouttes, ou même des sphères relativement grandes en état d'apesanteur. Et enfin les deux protons de ses atomes d'hydrogène ont tendance à adhérer aux électrons des atomes voisins. Ce phénomène additionné à la tension de surface explique également la capillarité. Grâce à leurs vaisseaux capillaires, même des arbres géants comme le séquoia sont capables de pomper l'eau du sol molécule par molécule, jusqu'à plus de cent mètres. C'est ainsi que l'eau «
mouille » à peu près tout ce qu'elle touche et qu'elle peut dissoudre un
grand nombre de substances. Mais elle « roule » sur celles qui
comportent également des protons orientés vers l'extérieur, la cire d'abeille
par exemple, dont la molécule contient pas moins de 94 atomes d'hydrogène. L'angle
vaut-il 109,5° ou 104,5° ? Tous les textes que j'ai pu consulter indiquent que dans la molécule de l'eau, l'angle des deux protons vaut 104,5° alors que celui des deux cônes d'ombre fait 109,5°. Puisque c'est sans doute exact, chacun des protons est donc légèrement moins incliné, la différence étant de 2,5°. Cette légère déviation
pourrait être le résultat de
l'effet de répulsion des deux électrons internes. Sachant que l'angle
d'un cône d'ombre est relativement ouvert et qu'il permet un certain jeu, il suffit d'observer
l'animation montrée au début de cette page pour le concevoir. Il se
pourrait aussi que la liaison des protons des atomes d'hydrogène avec
leur électron, qui est de nature magnétique, produise une force
additionnelle entre eux. Quoi qu'il en soit, cette légère anomalie ne
représente pas une objection majeure : elle s'explique sûrement d'une manière ou d'une autre. Les
cristaux de neige. Les chimistes montrent aussi que lorsque l'eau gèle, ses molécules s'assemblent normalement selon un tétraèdre régulier. On sait que malgré ses innombrables variantes, un cristal de neige forme fondamentalement un hexagone entouré de six pointes en étoile. Il faut donc que l'angle soit résolument de 60°. Il importe peu que l'angle de la molécule elle-même soit de 104,5° car c'est plutôt l'espace disponible autour d'elle qui détermine la forme définitive du cristal. Il faut d'abord comprendre que chaque proton est en mesure de capturer sur son axe une autre molécule d'eau, côté oxygène, et donc selon un angle voisin de 104,5°. Le deux nouvelles molécules se situent alors sur un axe parallèle à celui des deux protons. Mais ensuite, à cause de l'effet de répulsion de ces protons, l'espace opposé correspondant à l'atome d'oxygène, là où deux autres liaisons ioniques sont possibles, affecte la forme d'un ellipsoïde allongé. Ce dernier présente un axe orienté perpendiculairement au premier. On aboutit au tétraèdre régulier, qui est semble-t-il très commun en chimie, et qui présente des faces parfaitement triangulaires à 60°. Il est donc évident que chaque molécule alterne de chaque côté du plan du cristal de neige, de manière à former une structure hexagonale. Je possède un télescope, dont j'ai poli moi-même le miroir de 200 mm. Puisque je vis au Québec, j'ai eu souvent l'occasion d'observer à l'aide de cet appareil ces fameux cristaux de neige, à une distance d'environ 10 ou 20 mètres. Ils y apparaissent suffisamment agrandis pour qu'on puisse distinguer à merveille leurs formes variées. Mais surtout, pour un angle d'observation voisin de 45° qui correspond sans doute à celui du grand halo (46°) qu'on peut voir à travers les cirrus, ces cristaux prennent au soleil toutes les couleurs de l'arc-en-ciel. Contrairement
à l'arc-en-ciel, les couleurs varient au hasard et dépendent donc de
l'angle du cristal de neige lui-même. Même si la plupart des cristaux ne
sont pas colorés, le
spectacle est absolument féerique. Le violet y est particulièrement vif et
fascinant sur le fond
blanc de la neige. Il est intéressant de remarquer
que chaque cristal n'a qu'une seule couleur. Ceci indique nettement que
tout au long de sa formation, un cristal de neige conserve résolument son plan de
départ à une seconde d'arc près, sans jamais en dévier. Les
forces de Van der Waals. S'il est exact que les électrons ne tournent pas, les forces de Van der Waals s'expliquent quand même par des « dipôles ». L'idée demeure valable puisque certains électrons qui se font face entre deux objets peuvent fort bien subir en premier lieu un effet de répulsion et être expulsés vers l'arrière de leur atome, ou à tout le moins sur les côtés, si bien sûr il existe une place disponible. À ce moment il y a moins d'électrons pour exercer l'effet de répulsion habituel, ce qui se traduit par un effet d'attraction. Cette situation ne serait pas immédiatement réversible puisque l'électron ainsi déménagé est alors lié à un autre cône d'ombre. La force de Van der Waals correspondrait alors à celle qui est nécessaire pour le forcer à réintégrer sa position initiale. Toutefois, ces forces seraient aussi attribuables en partie aux cônes d'ombres, puisqu'il existe manifestement un point d'équilibre central où deux forces opposées sont égales et s'annulent. Par exemple, on peut faire coller un aimant sous une plaque de fer, mais toute force exercée vers le bas, la gravité par exemple, réduit la force du champ magnétique. Si on interpose plusieurs feuilles de papier entre l'aimant et la plaque de fer, le point d'équilibre sera éventuellement franchi et l'aimant tombera. Ainsi,
les cônes d'ombre continuent d'agir même au-delà de leur rayon effectif
normal, mais d'une manière beaucoup moins intense. Considérant
le rayon de valence d'un atome donné, celui-ci pourrait capturer jusqu'à
huit autres atomes situés un peu plus loin, à la condition
qu'au moins un de leurs électrons coïncide avec
l'un de ses cônes d'ombre. C'est particulièrement évident à l'intérieur d'un cristal, dont
la structure est ordonnée. Les
cônes d'ombre peuvent capturer un noyau d'atome. L'effet d'attraction d'un cône d'ombre n'a aucun lien avec la force de Coulomb, ce qui signifie qu'un atome peut tout aussi bien capturer le noyau d'un autre atome. Mais dans ce cas la distance qui sépare les deux noyaux vaut au moins le double, ce qui fait que la liaison est beaucoup moins forte. De plus, il faut que la structure générale de l'ensemble soit cohérente et relativement stable. On comprend alors que les molécules d'un gaz soient insensibles à cette force, que les liquides y fassent appel partiellement en plus des liaisons ioniques bipolaires, et que ce soit la règle générale dans le cas des solides. L'orientation des molécules aurait alors un effet déterminant, et cela expliquerait comment un gecko arrive à décoller facilement ses pattes tout en demeurant capable de se déplacer sous une lame de verre. Tout bien considéré, les forces de Van der Waals peuvent donc s'expliquer de trois manières différentes, qui pourraient agir simultanément. Il faudra donc les distinguer. |
| 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | Vous êtes ici. | 27 | 28 | 29 | 30 | 31 | 32 | 33 |
Gabriel LaFrenière, Bois-des-Filion en Québec. Dernière mise à jour le 7 juillet 2005. Sur l'Internet depuis septembre 2002. Courrier électronique : veuillez consulter cet avis. La matière est faite d'ondes, © Gabriel Lafrenière, juin 2002. |